LCC
Axe 1. La chélation sélective du Cu(II) et du Cu(I) (C. Esmieu)
Le premier axe est centré sur la conception de chélateurs capables d’éliminer le Cu du peptide amyloïde-β (Aβ). Diverses stratégies sont étudiées : chélation du Cu(I) et/ou du Cu(II) et effets associés sur la production de ROS et l’auto-assemblage de Aβ, impact du Zn(II) dans l’extraction du Cu de Aβ par les chélateurs, importance de la cinétique dans le processus d’élimination du Cu, utilisation de complexes « prodrugs » comme substituts moins toxiques des chélateurs, etc. La ligne de recherche la plus récente consiste à cibler sélectivement le Cu(I) avec des ligands traçables afin de suivre le devenir du complexe formé dans les milieux biologiques.
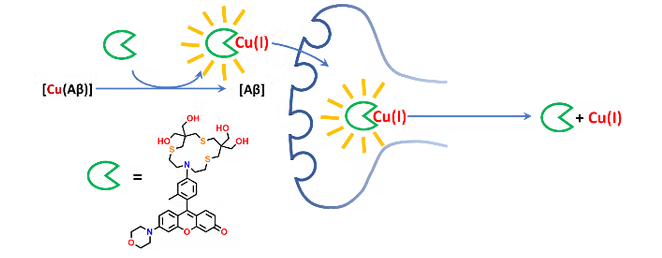
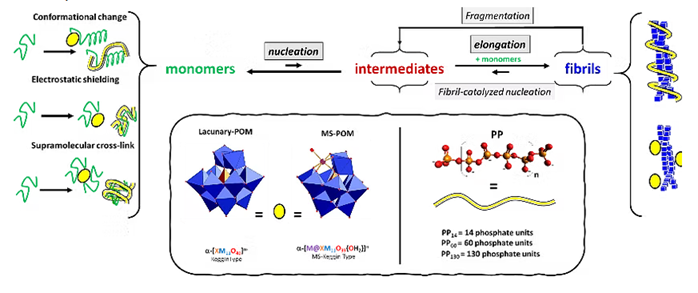
Axe 2. Echafaudages inorganiques comme modulateurs de l’auto-assemblage de peptides amyloïdogéniques (C. Hureau)
Nous utilisons des chaperons inorganiques naturels (polyphosphates, PP) ou synthétiques, c’est-à-dire des molécules capables de moduler le processus d’auto-assemblage de Aβ. Les chaperons artificiels comprennent des polyoxométallates (POM), les Keggin et Dawson lacunaires ou substitués par des métaux,des porphyrines et des complexes à base de Ln et Re.
LCC CNRS
Laboratoire de chimie de coordination du CNRS
205 route de Narbonne, BP 44099
31077 Toulouse cedex 4
France




