LCC
Longtemps considéré comme un simple résidu toxique de l’industrie chimique, le monoxyde d’azote (NO) est maintenant reconnu pour ses implications dans de nombreux mécanismes biologiques permettant entre autre de lutter contre le cancer, les bactéries, de réguler la pression sanguine ou la transmission de l’influx nerveux. Parmi les jalons de l’évolution de la recherche sur NO, signalons :
– 1992 : NO labélisée « molécule de l’année » par le journal Science
– 1997 : création du journal Nitric Oxide (impact factor = 4.4)
– 1998 : Prix Nobel attribué à la recherche sur NO
Les meilleurs agents sources de NO sont les complexes de ruthénium-nitrosyle (RuNO) qui libèrent NO sous irradiation lumineuse, selon la réaction ci-dessous :
[RuIIL5NO]n+/- + solvant → [RuIIIL5-(solvant)]n+/- + NO
L’intense activité de recherche qui résulte de leur étude est illustrée Figure 1. On note une multiplication par 5 du rythme annuel de publications durant les 20 dernières années.
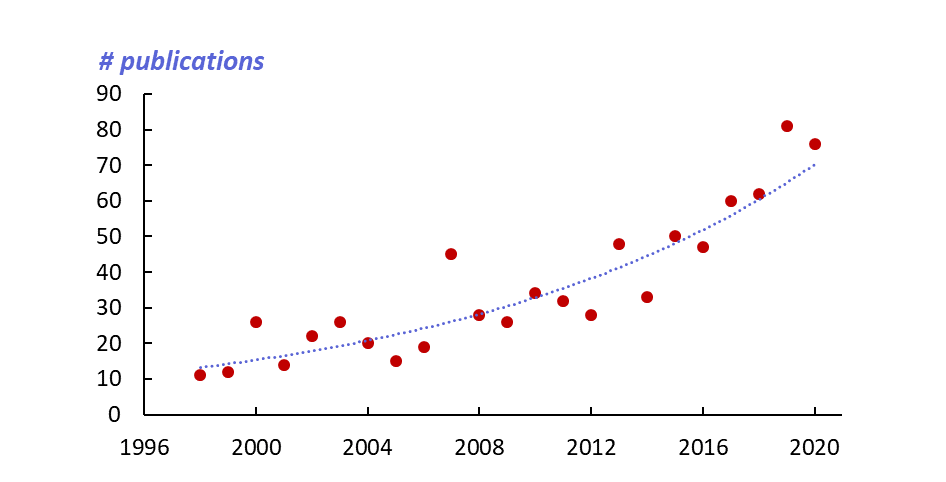
Figure 1 : Evolution du rythme annuel des publications sur les complexes RuNO.
(d’après le logiciel SciFinder)
Depuis sa création, l’objectif principal de l’équipe a été l’identification d’une molécule cible pour la libération photo-contrôlée de NO pour des applications biologiques. Le système sélectionné est constitué d’un cœur [Ru(terpy)(N0)]3+. Des exemples de tels complexes sont représentés Figure 2.
Sur la base de ces résultats, diverses directions de recherche sont développées dans l’équipe :
- optimisation de la propriété moléculaire ;
- étude théorique de l’origine des propriétés ;
- compatibilité des systèmes avec le milieu biologique ;
- mise en forme comme nano-objets.
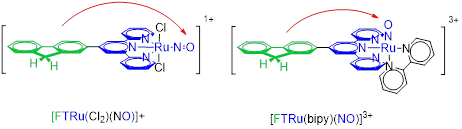
Figure 2 : Complexes RuNO, montrant le cœur Ru(terpy)(NO) en bleu, et le substituant fluorène donneur d’électron en vert. Les transferts de charge du donneur vers le ligand NO (fortement accepteur d’électrons), représentés par les flèches rouges, sont à l’origine des propriétés optiques et de la libération photo-induite de NO.
1. Optimisation de la propriété moléculaire
Deux obstacles s’opposent au développement de l’application des complexes RuNO en milieu biologique : (i) la toxicité inhérente à NO qui demande qu’il soit délivré localement et quantitativement et (ii) le besoin d’avoir recours à des radiations de longueur d’onde λ = 300 – 500 nm, c’est-à-dire en dehors de la gamme de transparence relative des tissus biologiques (λ = 600 – 1300 nm).
Ces écueils peuvent être évités en recourant à l’absorption à deux photons (TPA) dans laquelle la transition (300-500 nm) est opérée par l’absorption de deux photons de longueur d’onde double (600-1000) (voir Figure 3). La technique TPA offre en outre l’avantage d’être localisée au point focal du rayonnement, ce qui offre la possibilité de travailler sur une cellule ciblée, évitant ainsi les dommages collatéraux aux tissus sains.
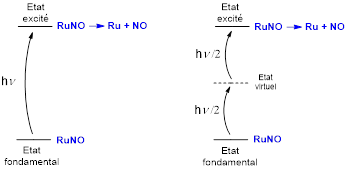
Figure 3 : Libération de NO par absorption d’un photon (à gauche) ou de deux photons (à droite).
Un exemple de synthèse de complexe RuNO capable de libérer NO à deux photons est représenté Figure 4.
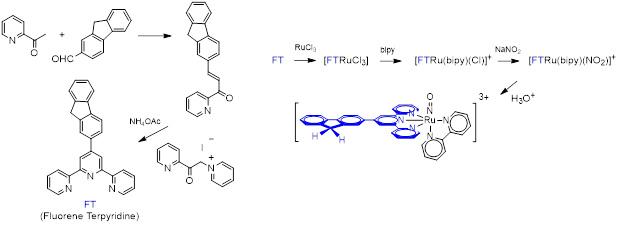
Figure 4 : Synthèse du complexe [FTRu(bipy)(NO)]3+.
Les propriétés TPA de ces systèmes sont étudiées par Z-scan, une technique donnant accès à la « section efficace moléculaire » (σ) qui quantifie la capacité de la molécule à absorber deux photons de manière similaire au coefficient d’extinction molaire utilisé pour l’absorption à un photon.
σ est exprimée en Goppert-Mayer (GM). Dans le cas de RuNO monométalliques les valeurs de σ varient entre 100 et 200 GM. Une approche encore plus ambitieuse consiste à étudier des RuNO polynucléaires comme ceux représentés à la Figure 5.
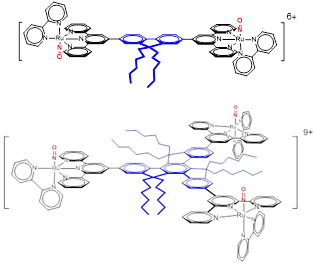
2. Études théoriques
Les complexes RuNO dans lesquels la conformation Ru – N – O est linéaire possèdent la structure électronique suivante :
[RuII (NO)+]
Si le ligand NO est considéré comme chargé « + » dans son niveau fondamental, il est invariablement observé que l’espèce libérée correspond au radical NO•. En d’autres termes, la photo-libération s’accompagne d’un transfert d’électron du complexe vers le ligand NO, avec création d’une lacune sur le ruthénium qui est formellement oxydé de RuII à RuIII, selon la réaction suivante :
[RuII (NO)+] → [RuIII•] + NO•
Ce schéma global apparaît compatible avec l’étude des spectres électroniques qui révèlent la présence d’un transfert de charge très intense lors des transitions de basse énergie, à fort caractère HOMO → LUMO, ainsi que le montre la Figure 6.
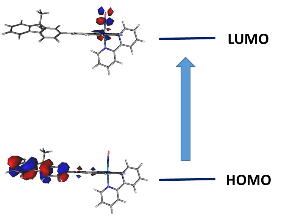
Figure 6 : Orbitales frontières impliquées dans la transition intense de basse énergie, du complexe [FTRu(bipy)(NO)]3+.
Cette description simplifiée est cependant insuffisante et plusieurs résultats expérimentaux nous conduisent à mener une étude théorique plus précise sur l’origine et le rendement quantique* de la photo-libération qui peuvent varier d’une espèce à l’autre. Les études sont conduites par la méthode DFT (Density Functional Theory) en collaboration avec une équipe de chimie théorique de Toulouse.
* le rendement quantique de photo-libération (φNO) est défini comme le nombre de molécules de NO libérées divisé par le nombre de complexes RuNO promus au niveau excité.
3. Compatibilité avec le milieu biologique
Les premières recherches consacrées aux RuNO conduites au laboratoire visaient à ne considérer ces systèmes que comme matériaux optiques commutables.
Ils étaient alors étudiés en milieu purement organique (acétonitrile) ou à l’état solide. Les regarder comme molécules biologiques impose d’avoir à les étudier dans l’eau.
Le complexe [FTRu(bipy)(NO)]3+ n’est stable qu’en milieu acide et évolue en [FTRu(bipy)(NO2)]+ après quelques minutes à pH=7.
Par contre, les complexes possédant la sphère de coordination [Ru(terpy)(Cl)2(NO)]+ se stabilisent sous la forme [Ru(terpy)(OH)(Cl)(NO)]+ qui manifeste une stabilité sur une échelle de temps considérable à l’abri de la lumière.
Il est intéressant d’observer que le composé final est le même, quel que soit l’isomère de départ, ce qui évite d’avoir recours à une méthode de séparation parfois très difficile à mettre en œuvre. La réaction est illustrée Figure 7.
Elle est observée pour tous les ligands tridentes de type terpyridines substituées.
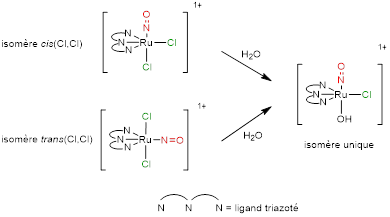
Figure 7 : Isomère trans(NO,OH) stable en milieu aqueux
4. Mise en forme comme nano-objets
L’utilisation des complexes RuNO dans les tissus biologiques pose la question délicate de leur mise en forme (molécules dispersées en solution, greffées à des nanoparticules, des dendrimères ou des polymères, insérées dans des structures micellaires, …). L’obtention de ces objets offre plusieurs avantages car au contraire des molécules isolées en solution qui ne peuvent pénétrer dans les cellules que par diffusion, ces objets peuvent être capturés par les cellules par des mécanismes beaucoup plus efficaces (ex. phagocytose) qui conduisent à un double effet :
– pénétration accrue des porteurs de NO
– libération de multiples unités NO présentes dans la particule porteuse
Les stratégies d’obtention de particules porteuses de NO sont nombreuses. Parmi celles-ci, nous développons une technique de nanoprécipitation. Des agrégats nanométriques du complexe trans(Cl,Cl)-[RuFTCl2NO]PF6 ont été stabilisés dans l’eau (Figure 8). Leur rendement quantique de photo-libération (φNO) est de l’ordre de 0.12.

Figure 8 : Image AFM de nano-agrégats du complexe trans(Cl,Cl)-[RuFTCl2NO]PF6 dispersés dans l’eau (tailles de 30 à 70 nm)
LCC CNRS
Laboratoire de chimie de coordination du CNRS
205 route de Narbonne, BP 44099
31077 Toulouse cedex 4
France




